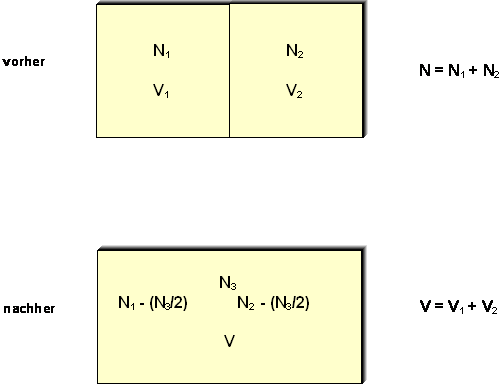
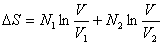Zwei Volumina V1 und V2
verschiedener idealer Gase enthalten Moleküle mit den
Teilchenzahlen N1 und N2,
die durch eine mechanisch feste, aber temperaturdurchlässige
Wand voneinander getrennt seien. In jedem der beiden Teilsysteme
herrsche die gleiche Temperatur T. Die Gesamtzahl der
Teilchen sei N = N1 + N2.
Nun werde die Trennwand entfernt, wobei jeweils ein Molekül der
einen Sorte mit einem Molekül der anderen Sorte in eine
chemische Reaktion trete, bei der zwei Teilchen entstehen, deren
Molekulargewicht gerade gleich dem Mittelwert der beiden
Einzelteilchen sei. Die Gesamtzahl der Teilchen ändert sich
dabei nicht, im Volumen V befinden sich jetzt lediglich
drei verschiedene Molekülsorten, wenn man davon ausgeht, daß
eines der beiden ursprünglichen Gase im Überschuß vorhanden war.
Auch müssen, nachdem sich ein Gleichgewicht eingestellt hat,
nicht alle Teilchen miteinander in Wechselwirkung getreten sein,
so daß immer noch Spuren der ursprünglichen Gase vorhanden sind.
Für die Entropie im Anfangszustand A können wir also
schreiben:
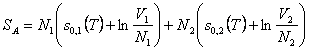 .
.
wobei s0,1(T) und s0,2(T)
die Entropien der beiden Gase pro Molekül seien. Da die Reaktion
bei konstanter Temperatur T abläuft, lautet die Entropie
im Endzustand E:
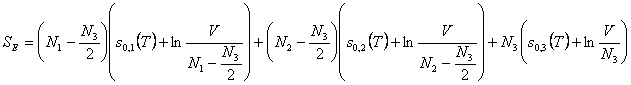
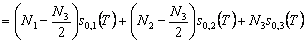
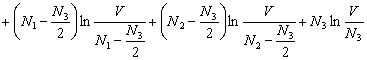
wenn N3 die Zahl der Teilchen des erhaltenen
Reaktionsproduktes ist. Die Entropie pro neu entstandenes
Teilchen ist der Mittelwert aus den Entropien jedes der beiden
Ausgangsteilchen:
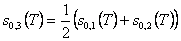
Berechnen wir damit die Entropiedifferenz, die sogenannte
Mischungsentropie, so erhalten wir den Ausdruck
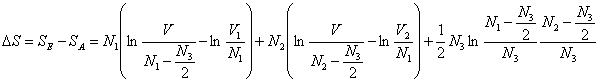
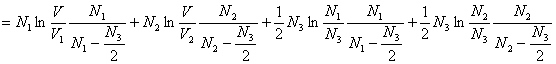
Wegen V > V1 und V > V2
sowie N1 > N3/2 und N2
> N3/2 folgt ΔS > 0, d.h. die Entropie
nimmt zu, weil die Durchmischung zweier Gase mit gleichzeitiger
Reaktion ein irreversibler Prozeß ist. Für N3
à
0, d.h. wenn keine chemische Reaktion zwischen den Molekülen
stattfindet, erhalten wir wie erwartet den entsprechenden
Ausdruck für ein zweikomponentiges ideales Gas: